EQUIPO#7 Página 2
INTEGRANTE#2
Abigail chan trujeque
AMIDAS
¿QUE SON?
Abigail chan trujeque
AMIDAS
¿QUE SON?
Es un compuesto orgánico que consiste en una amina unida a un ácido carboxílico convirtiéndose en una amina ácida (o amida). Por esto su grupo funcional es del tipo RCONH'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:
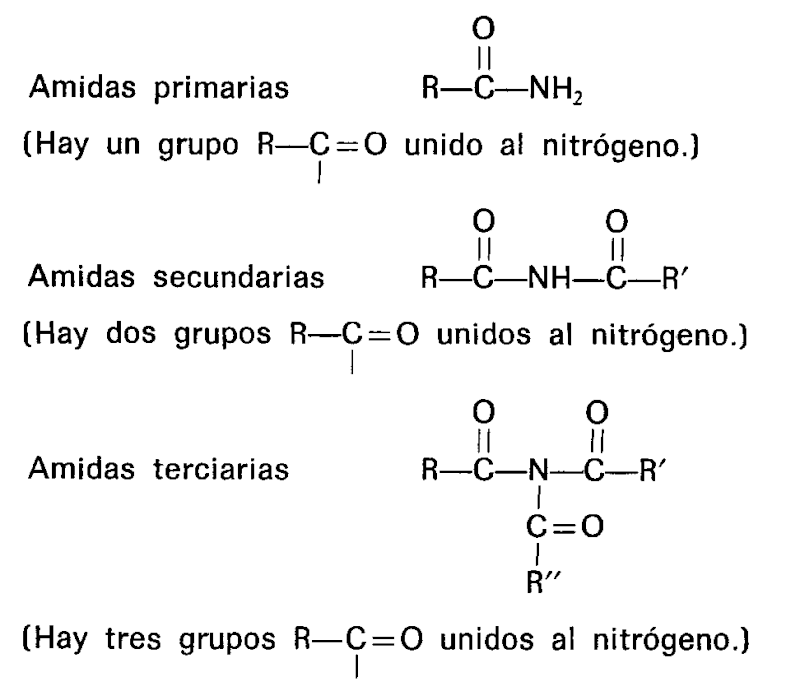
CLASIFICACIÓN DE LAS AMIDAS
Se pueden clasificar las amidas del modo siguiente:
1° Monoamidas: cuando derivan del tipo amoníaco sin condensar.
2° Diamidas: cuando derivan del tipo amoníaco bicondensado.
3° Triamidas: cuando derivan del tipo amoníaco tricondensado.
A su vez, cada uno de estos tipos se subdividen en varios géneros de acuerdo a la naturaleza del radical ácido que sustituye al hidrógeno:
ESTRUCTURA
su estructura el grupo amino, -NH2. Se pueden considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR'. Su fórmula general es:

NOMENCLATURA

FORMULACIÓN
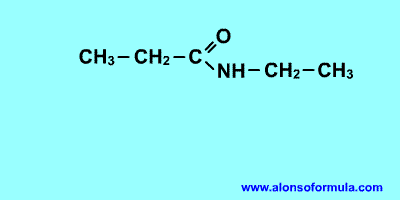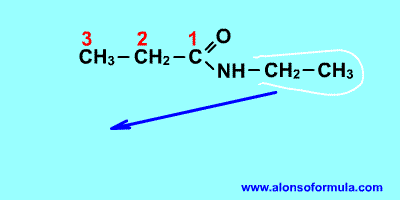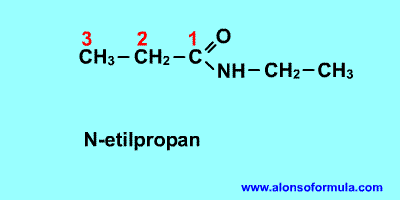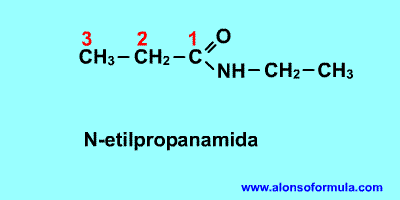 |
Nombra los radicales unidos al nitrógeno precedidos de la N. Luego nombra la cadena que contiene el carbonilo terminada en -amida
FORMULA GENERAL
ESTRUCTURA DE LA AMIDA
 |
PROPIEDADES FÍSICAS
Salvo la formamida, que es líquida, todas las amidas primarias son sólidas, de punto de fusión preciso. Casi todas las amidas son incoloras e inodoras. Los miembros inferiores de la serie son solubles en agua y en alcohol; la solubilidad en agua disminuye conforme aumenta la masa molar. El grupo amida es polar y, a diferencia de las aminas, las amidas son moléculas neutras. El par de electrones no compartido no se localiza sobre el átomo de nitrógeno, sino que se encuentra deslocalizado, por resonancia, en el átomo de oxígeno del grupo carbonilo. La estructura iónica dipolar restringe la libre rotación del enlace carbono-nitrógeno. Esta limitación geométrica tiene importantes consecuencias en la estructura de las proteínas.
Las propiedades químicas de las aminas son semejantes a las del amoniaco. Al igual que éste, son sustancias básicas; son aceptores de protones, según la definición de Brønsted-Lowry.
Las aminas presentan reacciones de neutralización con los ácidos y forman sales de alquilamonio (también denominadas sales de amina). Por ejemplo la etilamina se combina con el ácido clorhídrico, para producir cloruro de etilamonio.
Un uso práctico para convertir las aminas a sus sales es el producir aminas de mayor masa molecular y solubles en agua. La mayoría de las aminas de gran masa molecular son insolubles en agua, pero después de combinarse con un ácido forman una sal de amina iónica soluble. Por ejemplo, la lidocaína, un anestésico local que es insoluble en agua como amina libre; después de combinarse con el HCl forma un clorhidrato de lidocaína el cual es soluble en agua
APLICACIONES Y USOS
Las amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas, vitaminas. Es utilizada en el cuerpo para la excreción del amoníaco (NH3).
Muy utilizada en la industria farmacéutica, y en la industria del nailon.
AMIDAS

Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino)
página anterior AUTORA:Maria Abigail Chan Trujeque

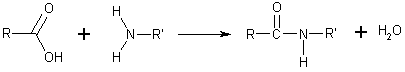

Jamás creí que una amiba tenga clasificaciones yo siempre creí que la amiba sólo era una gran información buen trabajo chicos gracias por la informacion
ResponderBorrar